Тканевая инженерия позволяет создавать биологические структуры, широко используемые в регенеративной медицине. Однако до появления 3D-биопечати доступные технологии позволяли производить только относительно простые структуры. Действительно, искусственные ткани сердца, например, производятся путем отливки смеси белков внеклеточного матрикса (ECM), кардиомиоцитов и других типов сердечных клеток в основу.
Этот метод позволяет производить структуры с упрощенной геометрией, такие как нити, кольца или сетки. Желудочки в форме шара также были созданы с использованием специальных форм или путем внедрения биочернил, наполненных клетками, в твердые каркасы, напечатанные на 3D-принтере.
Однако эти методы имели ограничения, поскольку не позволяли генерировать ткани со сложной многоклеточной структурой. И хотя сейчас технологии 3D-биопечати могут использоваться для создания гораздо более сложных структур, они по-прежнему сталкиваются с рядом проблем.
Большинство тканей и органов в нашем организме выполняют очень сложные функции, которые современные технологии 3D-биопечати не в состоянии воспроизвести в точности. Сердечная ткань является одной из таких структур, поскольку клетки, из которых она состоит, имеют автономный механизм сокращения. В сердце эти клетки бьются в унисон в соответствии с очень точным ритмом, чтобы снабжать кровью все тело.
Эта сократимость должна равномерно распределяться ритмично по сети полостей (желудочки и предсердия) и осуществляется через ионные каналы (регулирующие кальциевый, калиевый и др. гомеостаз). Лабораторное воспроизведение этого сложного строения ткани, способного автономно активироваться в пределах целого органа, является одной из самых сложных задач 3D-биопечати.
С помощью новейших методов удалось создать миниатюрные органы, включая полости и главные сосуды. Это делается с помощью кардиомиоцитов, полученных из индуцированных человеком плюрипотентных стволовых клеток (hiPSC-CM) и встроенных в матрицу, полученную из сальника (мембрана, выстилающая стенки брюшной полости и покрывающая и поддерживающая органы), которые были непосредственно напечатаны. Однако, несмотря на структурное мастерство, не удалось установить ни электрическую активность, ни сократимость.
Предыдущим исследователям удалось добиться электрической активности, используя тип биочернил для создания мягких гидрогелей. Хотя полученная структура состояла из взаимосвязанных сетей сердечных клеток, способных спонтанно сокращаться, геометрическая сложность, которой можно было достичь, была относительно ограниченной.
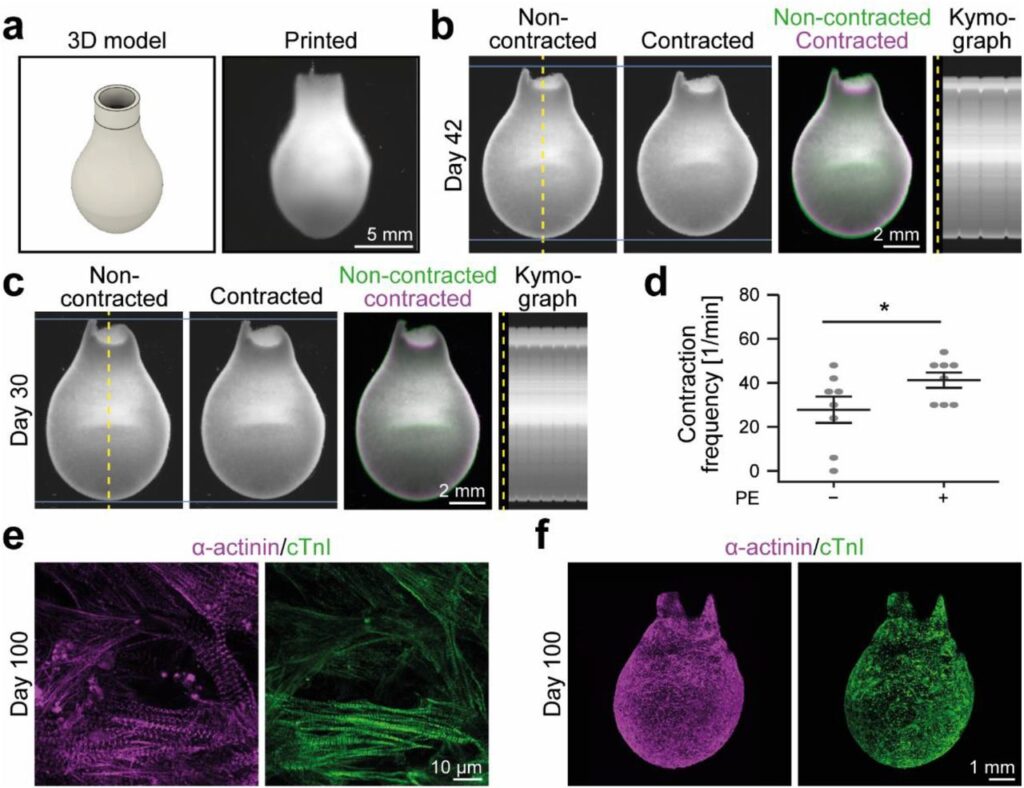
Новое исследование, доступное в предварительной публикации на , предлагает преодолеть некоторые из этих проблем путем разработки технологии прямой печати hiPSC-CM. Цель состоит в том, чтобы получить функциональную конструкцию сердечной ткани. Новое устройство, разработанное исследователями из Эрлангенского университета имени Фридриха-Александра в Нюрнберге, позволило получить структуры от простых колец до настоящих миниатюрных желудочков, которые сокращаются спонтанно более 100 дней подряд. Силу сокращения также можно регулировать с помощью фармакологических стимулов.
Процесс печати гелем
Протокол, разработанный исследователями, включает в себя предварительный гелевый раствор коллагена, который может быть напечатан в ванне, состоящей из второго геля, служащего в качестве опоры. Будучи одним из самых распространенных белков в сердце, коллаген хорошо совместим с инженерией сердечной ткани. Однако коллагеновые гидрогели особенно трудно печатать после их застывания.
В процессе печати «в геле» они преодолевают это препятствие, используя опорную ванну в качестве стабилизатора. Точнее, эта техника позволяет гидрогелю (биочернилам) сохранять жидкую форму достаточно долго, чтобы печатающее сопло прошло через ванну поддержки.
Для печати hiPSC-CMs сложной формы исследователи сначала разработали поддерживающую ванну, состоящую из микрочастиц желатина и гуммиарабика. Когда эти микрочастицы уплотняются при центрифугировании, они образуют самовосстанавливающуюся опору, позволяющую печатной насадке проходить через них без повреждений и одновременно стабилизирующую всю структуру. Биочернила — смесь предварительно гелированного коллагена и гиалуроновой кислоты, содержащая клетки — вводятся внутрь этой опоры для печати нужной формы. После завершения процесса печати гель для поддержки растворяется, оставляя только конечную структуру.
Используя этот протокол, исследователи получили структуру в форме шара, способную сокращаться автономно. Высота искусственного желудочка составляет 14 миллилитров, а диаметр основания — около 8 миллиметров. Для сравнения, желудочки среднего человеческого сердца в шесть раз больше.
В ближайшем будущем исследователи планируют перенести этот протокол на полноценное сердце с двумя желудочками и двумя сокращающимися предсердиями. Однако эта цель сопряжена и с другими проблемами: например, поскольку миокард также имеет большое количество кровеносных сосудов (не считая коронарных сосудов) и нервов, для конструирования действительно функционального органа потребуются другие типы биочернил. Здесь снова необходимо будет проверить межфункциональность различных тканей.


